Tendine parasole bambini Buio Ottimale con protezione UV certificata - accessori auto, 2 pezzi 51x31cm, protezione solare raggi UV Design Tartaruga
11,99 € (a partire da 26 Aprile 2025 00:29 GMT +02:00 - Altre informazioniProduct prices and availability are accurate as of the date/time indicated and are subject to change. Any price and availability information displayed on [relevant Amazon Site(s), as applicable] at the time of purchase will apply to the purchase of this product.)La batteria al piombo-acido è un tipo comune di batteria utilizzato in molti veicoli e sistemi di alimentazione di emergenza. Funziona grazie a una reazione chimica che si verifica tra due tipi di materiali: il piombo e l’acido solforico. Ecco come funziona in modo semplice passaggio punto per punto:
Componenti, Carica e Scarica:
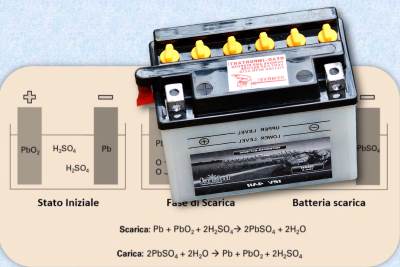
- Anodo e catodo: All’interno della batteria, ci sono due piastre, una chiamata anodo e l’altra catodo. L’anodo è realizzato in piombo poroso, mentre il catodo è ricoperto di diossido di piombo (PbO2). Queste due piastre sono immerse in una soluzione di acido solforico (H2SO4).
- Reazione chimica: Quando la batteria viene collegata a un dispositivo o a un veicolo che richiede energia, inizia una reazione chimica. Gli ioni di piombo dell’anodo reagiscono con gli ioni di solfato dell’acido solforico per formare ioni di piombo solido (PbSO4) e rilasciare ioni di idrogeno (H2). Allo stesso tempo, gli ioni di diossido di piombo del catodo reagiscono con gli ioni di solfato per formare ioni di piombo solido e ioni di acqua (H2O).
- Flusso di elettroni: Queste reazioni chimiche generano elettroni nell’anodo. Gli elettroni cercano un percorso verso il catodo e lo trovano attraverso il dispositivo collegato alla batteria, dopo aver attraversato il catodo si ricombinano con gli ioni di idrogeno e gli ioni di acqua per formare molecole di acqua. Questo flusso di elettroni attraversando il circuito esterno è ciò che fornisce l’energia elettrica utilizzabile nel circuito esterno stesso.
- Alla fine della reazione: alla fine della reazione chimica, quando entrambe le piastre sono ricoperte di ioni di piombo solido (PbSO4) e la concentrazione dell’acido nell’elettrolita è troppo bassa, la batteria è scarica e per poterla riutilizzare nuovamente deve essere ricaricata.
- Ricarica della batteria: Quando si ricarica la batteria, si inverte la reazione chimica applicando una tensione dall’esterno. Questo forza gli ioni di piombo e solfato a tornare alle loro posizioni originali sulle piastre, ripristinando al contempo la concentrazione dell’acido nell’elettrolita. Alla fine del processo inverso, si è pronti per una nuova scarica.
Approfondiamo un po’ e vediamo le caratteristiche principali
- Composizione delle piastre: All’interno della batteria al piombo-acido, le piastre sono composte da materiale a base di piombo. L’anodo è costituito da piombo poroso, mentre il catodo è ricoperto di diossido di piombo (PbO2). Questa scelta dei materiali consente la realizzazione delle reazioni chimiche necessarie per produrre e immagazzinare energia.
- Elettrolita: L’acido solforico (H2SO4) funge da elettrolita all’interno della batteria. L’elettrolita svolge un ruolo fondamentale nel trasferimento degli ioni elettricamente carichi tra le piastre, permettendo così il flusso di corrente elettrica attraverso il circuito esterno quando la batteria è collegata.
- Scarica e produzione di energia: Durante la scarica, la reazione chimica tra il piombo dell’anodo, il diossido di piombo del catodo e l’acido solforico genera elettroni liberi nell’anodo. Questi elettroni cercano un percorso attraverso il circuito esterno per raggiungere il catodo, creando una differenza di potenziale e producendo energia elettrica utilizzata nel circuito esterno stesso.
- Ricarica: Quando si ricarica la batteria, si inverte il processo chimico. Applicando una tensione esterna maggiore rispetto alla tensione prodotta durante la scarica, si costringono gli ioni di piombo e solfato a tornare alle loro posizioni originali sulle piastre. Questo processo ripristina la carica elettrochimica della batteria, pronta per una nuova scarica.
- Capacità e durata: La capacità di una batteria al piombo-acido è misurata in ampere-ora (Ah) ed è una misura della quantità di energia che può immagazzinare. La durata della batteria dipende da come viene utilizzata e da vari fattori, tra cui la corrente di scarica e la temperatura ambientale.
- Manutenzione: Le batterie al piombo-acido richiedono una manutenzione periodica. In particolare, è importante controllare il livello dell’acido all’interno della batteria e, se necessario, aggiungere acqua distillata per mantenere il livello ottimale dell’elettrolita. Inoltre, le batterie possono essere sensibili alla scarica profonda e prolungata, che può ridurne la durata della vita della batteria stessa. La ricarica prima che la batteria sia totalmente scarica è fondamentale per mantenere la batteria in efficiente e prolungarne la vita utile. La manutenzione appena descritta vale per le batterie dove l’elettrolita è liquido e tende quindi ad evaporare facilmente, ma si vanno usando sempre più le batterie con elettrolita gel che evaporare molto più difficilmente, e quelle AGM dove l’elettrolita è addirittura assorbito in piastre di materiale isolante poroso che riduce l’evaporazione. Siccome la mggior parte delle batterie attualmente in commercio è gel o AGM, in pratica la manutenzione è ridotta all’ispezione visiva e la misura della tensione e del trend di scarica (nelle automobili queste misure sono fatte dal sensore IBS).
Vediamo le reazioni chimiche di carica e scarica nei dettagli:
- Scarica: Durante la scarica, la reazione chimica all’anodo è la seguente:
Anodo (negativo): Pb + HSO4- -> PbSO4 + H+ + 2e-
Questa reazione converte il piombo metallico (Pb) in solfato di piombo (PbSO4) e rilascia ioni di idrogeno (H+) ed elettroni (e-). Gli elettroni vengono raccolti nell’anodo e attraversando il circuito esterno, arrivano al catodo per rientrare nella batteria. Nel frattempo alimentano il circuito del dispositivo esterno che attraversano e lo fanno funzionare fornendogli energia.
Allo stesso tempo, al catodo (positivo) si verifica la seguente reazione:
Catodo (positivo): PbO2 + 3H+ + HSO4- + 2e- -> PbSO4 + 2H2O
Questa reazione converte il diossido di piombo (PbO2) in solfato di piombo (PbSO4) e acqua (H2O).
2.Batteria Scarica: Quando nell’elettrolita c’è troppa acqua (cioè una bassa concentrazione dell’acido nel liquido) e, le piastre sono ricoperte di solfato di piombo (PbSO4), la batteria non riesce più a fare l reazione chimica e si considera scarica.
3.Ricarica: Durante il processo di ricarica, le reazioni chimiche vengono invertite applicando una tensione esterna alla batteria. Ciò costringe gli ioni di piombo e solfato a ritornare alle loro forme originali, pronti per una nuova scarica. Questo processo rigenera la batteria.
Vantaggi delle batterie al piombo-acido
- Costo: Le batterie al piombo-acido sono relativamente economiche da produrre rispetto ad alcune tecnologie di batterie più avanzate, rendendole la tecnologia più scelta in applicazioni dove il costo è un fattore determinante.
- Affidabilità: Queste batterie sono note per la loro affidabilità e durata. Se manutenute correttamente, possono durare diversi anni.
- Alte correnti di scarica: Le batterie al piombo-acido sono in grado di fornire correnti di scarica elevate, rendendole adatte per applicazioni che richiedono potenza immediata, come nei motorini di avviamento auto.
Svantaggi delle batterie al piombo-acido:
- Peso e dimensioni: Sono più pesanti e voluminose rispetto a molte altre tecnologie di batterie, il che può limitarne l’uso in applicazioni in cui lo spazio e il peso sono fattori importanti.
- Bassa densità energetica: Le batterie al piombo-acido hanno una densità energetica relativamente bassa rispetto alle batterie agli ioni di litio e ad altre tecnologie più avanzate, il che significa che possono immagazzinare meno energia per unità di volume o peso.
- Autoscarica: Queste batterie tendono ad autoscaricarsi lentamente nel tempo, anche quando non sono in uso. Ciò significa che è necessario mantenerle costantemente cariche o ricaricarle periodicamente per evitare danni irreversibili.
Le batterie al piombo-acido sono ampiamente utilizzate in veicoli come automobili, moto e scooter, oltre a essere impiegate in sistemi di alimentazione di emergenza, come gruppi elettrogeni. Offrono una fonte di energia affidabile e relativamente economica, ma hanno alcune limitazioni, come la necessità di manutenzione periodica e la densità energetica relativamente bassa rispetto ad alcune tecnologie più moderne.